西湖大学郑钜圣、郭天南、中山大学陈裕明团队等合作发表的新研究发现:肠道菌群与人体促炎症因子呈正相关,进而可能是健康个体重症新冠肺炎易感性的基础。
当地时间4月25日,医学预印本平台medRxiv在线发表了题为 “Gut microbiota may underlie the predisposition of healthy individuals to COVID-19”的研究文章(未经同行审议),研究团队包括西湖大学浙江省生长调控和转化研究重点实验室、中山大学公共卫生学院重点实验室等。
新型冠状病毒肺炎(COVID-19)全球大流行的背景下,不同个体的易感性成为科学家们的研究课题之一。据世界卫生组织(WHO)报告,新冠肺炎患者80%症状较轻,但在缺乏医疗资源的情况下,新冠肺炎患者的重症转化率可高达20%,并且重症患者整体死亡率可超过50%。
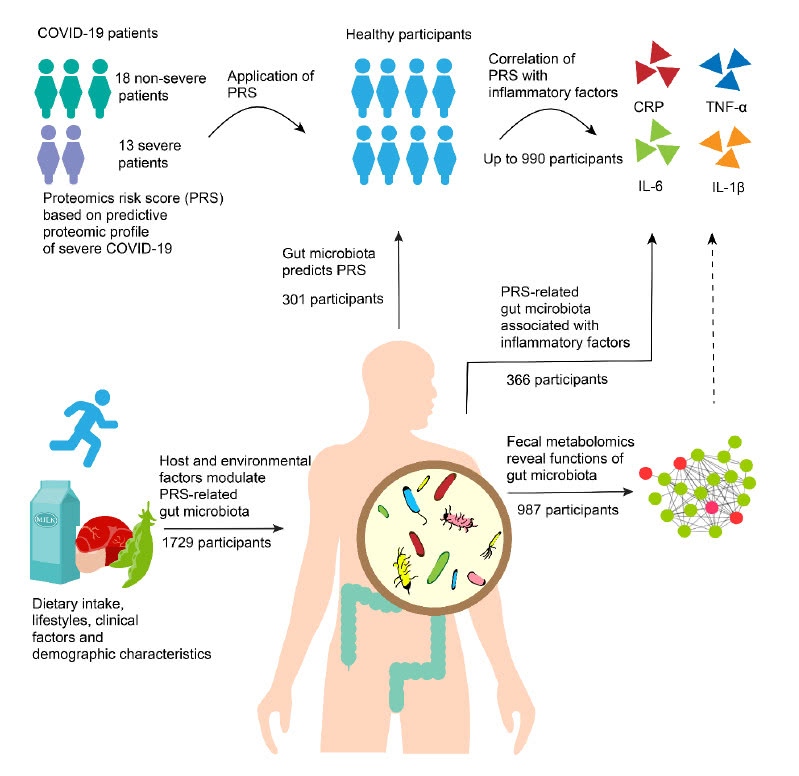
西湖大学等团队的这项最新研究探讨了健康个体体内可能预测重症新冠肺炎易感性的生物学机制。研究构建了一个基于20种血液生物标志物的蛋白质组风险评分系统,这些标志物能够预测严重COVID-19的进展,而机器学习模型证明,肠道菌群可以准确地预测上述血液生物标志物,同时与促炎细胞因子高度相关。
粪便代谢组学分析表明,潜在的氨基酸相关途径将肠道菌群与炎症联系起来。
这也就说明,肠道菌群可能是健康个体患严重新冠肺炎的诱因。
迄今为止,根据已经发表的许多研究论文,年龄较大、男性或患有其他临床合并症的个体被认为更有可能发展为严重的COVID-19病例。然而,科学界对于这种疾病的易感性的潜在生物学机制或预测因子还知之甚少。
这一研究针对不同个体中新冠肺炎易感性及其进展的巨大差异进行了说明,阐述了不同人群之间易感性差异背后的潜在生物学机制。有必要注意一下的是,该研究还为发现新冠治疗药物开发的潜在靶标作了贡献,研究指出,核心肠道微生物特征和相关代谢产物可能作为潜在的预防易感人群的靶标。
构建风险评分:有效预测健康个体对于重症新冠肺炎的易感性
多项研究已经证明,人血管紧张素转换酶2(hACE2)是新冠病毒入侵人体细胞的关键受体,而有必要注意一下的是,ACE2是肠道炎症的重要调节因子,并且ACE2在回肠和结肠中的表达量要高于肺。
此前的研究表示,ACE2对肠道菌群的组成也有及其重要的作用,从而影响心肺疾病的形成。此外,超过60%的新冠肺炎患者有胃肠道症状,如腹泻、恶心和呕吐,并且有胃肠道症状的患者更容易恶化成严重或危重病例。
这些证据表明,肠道微生物群在新冠肺炎的易感性和恶化过程中可能发挥着及其重要的作用。
此前,针对新冠肺炎患者血液生物标志物的研究已经确定了一组能够在一定程度上帮助预测新冠肺炎患者的病情进展的蛋白。然而,对于健康人群而言,这些生物标志物可否用于预测人们对新冠肺炎的易感性、肠道菌群是否能调节这些生物标志物,目前还不清楚。
研究设计和分析流程
为了解决上述问题,研究人员收集了31名新冠肺炎患者(13名为重症患者)的血液蛋白质组学数据和来自广州的2413名未感染健康者的多组学数据。基于20种蛋白质组生物标志物数据,团队构建了血液蛋白质组学风险评分(PRS),用于预测重症新冠肺炎。
在COVID-19患者中,回归分析表明,PRS每增加10%,患者进展为临床严重阶段的风险就增加57%,这表明PRS能够作为严重新冠肺炎预后的生物标志物。
然后,根据990名健康个体的蛋白质组和血液炎症生物标志物数据,研究人员调查了新冠肺炎相关的PRS与炎症生物标志物的相关性,以验证PRS与非感染个体的疾病易感性的关系。他们发现,这一PRS与促炎细胞因子呈正相关,这也说明,团队构建的PRS能够有效预测健康个体对于重症新冠肺炎的易感性。
有必要注意一下的是,研究人员发现,老年人更容易有较高的风险评分,而年轻人该评分较低,性别对该评分没有显著影响。
肠道菌群与未感染个体的COVID-19易感性关联,可作为治疗靶标
为了研究肠道菌群对健康个体中COVID-19易感性的潜在作用,研究团队接下来运用机器模型方法,在有301名参与者的子队列研究中讨论了肠道菌群与上述COVID-19相关的PRS之间的关系,并测量了两种肠道微生物群(16s rRNA)和血液蛋白质组学数据。
核心微生物OTU和宿主炎性细胞因子的相关性
通过保守且严格的机器模型方法,研究团队确定了肠道菌群中20个预测性最高的操作分类单位(OTU),这些核心OTU平均解释了21.5%上述PRS的变化。这些OTU主要属于拟杆菌属、链球菌属、乳杆菌属等。
此外,团队使用协惯性分析(CIA)进一步测试了20个核心OTU和上述的20个严重COVID-19的预测蛋白质组学生物标记之间的协方差,结果表明这些OTU与蛋白质组生物标志物密切相关。
重要的是,上述分析结果能够在包含169个个体的独立亚组中成功复制,这些发现都表明,在新冠肺炎病情的发展中,肠道微生物群的指标改变可能先于血液蛋白质组生物标记物的改变。
进一步的粪便代谢组学分析揭示了潜在的生物学机制,研究人员评估了987名参与者的核心肠道菌群与粪便代谢组之间的关系,发现在所有样本中,共有183种粪便代谢物与至少一种选定的微生物OTU有显著相关性。
有必要注意一下的是,45种氨基酸、脂肪酸和胆汁酸类别的粪便代谢物与超过一半的选定微生物OTU呈显著关联,这表明这些代谢物可能在介导核心肠道菌群对宿主代谢和炎症的影响中起关键作用。
最后,团队发现了40个宿主和环境因素会造成上述核心肠道菌群特征变异,包括性别、教育程度、体育活动、舒张压、血糖、血脂、2型糖尿病的药物使用等人口统计学或临床因素;也包括乳制品消费等饮食、营养类别因素。
总体而言,这些发现将肠道菌群与未感染个体的COVID-19易感性联系了起来。在健康的未感染个体中,肠道微生物特征可高度预测严重COVID-19疾病的血液蛋白质组学生物标志物,相应肠道微生物组特征的破坏可能使健康个体处于异常的炎症状态。
事实上,在国家卫健委发布的新冠病毒疾病诊断和治疗计划(第6版)中,已经建议将维持肠道稳定状态作为治疗选择,从而保持肠道微生态平衡并防止继发性细菌感染。
研究团队认为,这项研究结果提供了重要的证据和建议,说明了不同人群之间易感性差异背后的潜在生物学机制。
另外,慢慢的变多的证据表明,“细胞因子风暴”是炎性细胞因子的过度产生,可能是导致COVID-19患者严重程度和死亡的重要机制。因此,抑制患者高炎症状态的抗细胞因子疗法是治疗重症COVID-19患者的推荐策略。
而本研究中20种严重COVID-19的蛋白质组预测因子中,几种最上调(upregulated)的蛋白,如血清淀粉样蛋白A-1(SAA1)、SAA2、SAA4、α-1-抗胰凝乳蛋白酶,属于活化的急性蛋白。这些蛋白质可以在新冠病毒入侵后与促炎细胞因子(如IL-6和TNF-α)一起被激活。
因此,研究团队还提出,这组蛋白质组学生物标志物可当作治疗新冠病毒感染的重要生物标志物或治疗靶标,也可当作新冠治疗药物开发的潜在靶标。












